靶向下丘脑脂质代谢的纳米医学可能是控制肥胖的潜在方法
肥胖等代谢紊乱导致的饮食摄入和输出之间的不平衡会破坏能量稳态。尽管在了解这些代谢紊乱的发病机制方面取得了重大进展,但肥胖和2型糖尿病的患病率仍在继续上升,并且仍然是一个未满足的医学挑战。
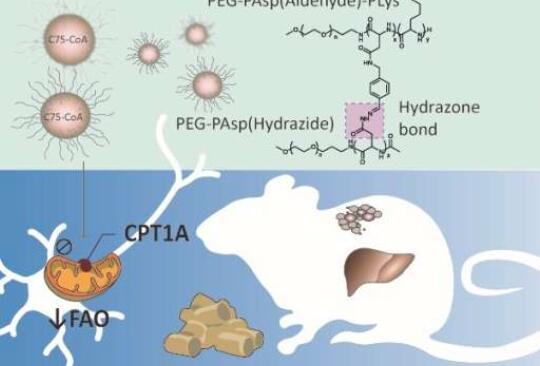
中枢神经系统(CNS)紧密调节能量平衡的生理控制,以下丘脑为焦点区域。大量证据表明,下丘脑的脂质代谢是影响摄食行为和外周代谢的关键营养状态信号。值得注意的是,脂肪酸(FAs)或其代谢物在下丘脑神经元中的积累起到饱腹感信号的作用,并可能减少食物摄入量和肝功能。
线粒体酶肉碱棕榈酰转移酶1A(CPT1A)促进长链FA进入β氧化,是调节能量平衡的脑脂质代谢的关键靶点。由于CPT1A在中央和外周组织中高度表达,因此其在能量平衡中的调节潜力基于两种不同的干预措施。在外周组织(即肝脏和脂肪组织)中,过表达CPT1A和诱导脂肪酸氧化(FAO)可改善胰岛素抵抗并防止体重增加。相反,在中枢神经系统中,CPT1A抑制会减少食物摄入量和体重。因此,CPT1A在下丘脑中的特异性抑制而不是在外周组织中的特异性抑制为特征的代谢性疾病提供了一种前瞻性的治疗选择,其特征是能量稳态失衡。
研究人员在一项多机构合作中报告说,一种创造性的交联聚合物胶束型纳米医学平台稳定地封装了CPT1A抑制剂C75-CoA,靶向脑脂质代谢,以减弱小鼠的食物摄入和外周代谢。巴塞罗那大学(西班牙巴塞罗那)的几位研究人员也参与了这个项目。这项工作发表在《生物材料科学》杂志上。
C75是一种众所周知的CPT1A抑制剂,在下丘脑中转化为其活性辅酶A(CoA)形式。C75的对映选择性合成表明,(+)-C75和(±)-C75-CoA加合物是抑制CPT1A的活性形式,尽管该化合物最初被发现为脂肪酸合酶(FAS)抑制剂,通过丙二酰辅酶A积聚具有有效的厌食作用。因此,必须将(±)-C75-CoA直接运输到大脑中进行CPT1A抑制和能量平衡管理,以防止对FAS的脱靶效应和外周的不良影响。
目前的出版物报告了一种具有高CPT1A抑制剂(±)-C75-CoA截留效率的稳健核心交联聚合物胶束(PM)型纳米药物的开发。在脑室内(ICV)给药后,交联PM在脑室(ICV)给药后,在脑细胞中递送CPT1A抑制剂时表现出优异的生物活性,特别是向神经元递送,使交联PM对体内应用有价值。
此外,与游离药物相比,这种(±)-C75-CoA负载的核心交联PM的集中给药显着降低了小鼠的食物摄入量和体重,同时还显着调节食欲相关的神经肽,激活神经元的特定下丘脑区域,并改变外周组织中代谢生物标志物的表达。
本研究的新颖性和意义
由于难以达到特定的大脑目标,控制喂养、体重和葡萄糖稳态的代谢疾病(如肥胖或糖尿病)的治疗不足。目前的研究报告了第一个基于纳米药物的平台,该平台作用于大脑靶标,以驱动食物摄入和外周代谢的快速调节,为管理代谢疾病提供了一种创新方法。本研究的关键意义如下:
本研究中使用的基于核心交联聚合物胶束的纳米药物允许封装一种改变大脑中脂质代谢的药物,这是传统制剂难以达到的目标。
药物的有效递送和更高的神经元摄取证明在小鼠中枢施用负载有C75-CoA的核心交联聚合物胶束引起的有效和快速的饱腹感和显着的体重减轻,以及食欲相关的下丘脑神经肽和参与摄食行为的下丘脑核的神经元激活的实质性调节, 未观察到对游离(±)-C75-CoA治疗的反应。
这项研究可以通过专注于大脑脂质代谢来控制食物和体重,从而有可能创建和验证新一代基于纳米医学的策略。
此外,这项工作强调了纳米技术超越其当前生物用途的重要性。它使人们更容易理解能量平衡的早期阶段(即急性饱腹感作用),这对于肥胖和糖尿病等复杂疾病的出现至关重要。
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!
-
【经典句子大全】在日常生活中,无论是写作、演讲还是表达情感,一句经典的句子往往能起到画龙点睛的作用。它...浏览全文>>
-
【经典句句戳心的话】在生活的长河中,有些话虽然简单,却能直击人心,让人久久不能忘怀。这些句子往往蕴含着...浏览全文>>
-
【经典精辟句子】在日常生活中,我们常常会遇到一些让人深思、令人难忘的句子。这些句子简洁有力,富有哲理,...浏览全文>>
-
【经典惊悚片有哪些】惊悚片以其紧张的节奏、扣人心弦的情节和令人不安的氛围,成为电影史上最受欢迎的类型之...浏览全文>>
-
【经典教师简单自我介绍】在教育工作中,教师的自我介绍是展示个人风格、教学理念和职业态度的重要方式。一个...浏览全文>>
-
【经典简短句子一句话】在日常生活中,一句经典而简短的句子往往能给人留下深刻印象。它们简洁有力,蕴含深意...浏览全文>>
-
【禁不住念什么】在日常生活中,我们常常会遇到一些词语让人“禁不住”去读、去想,甚至去写。其中,“禁不住...浏览全文>>
-
【禁闭岛结局】《禁闭岛》(英文名:Shutter Island)是一部由马丁·斯科塞斯执导,莱昂纳多·迪卡普里奥主演...浏览全文>>
-
【禁闭岛的结局真相】《禁闭岛》(英文名:Shutter Island)是一部由马丁·斯科塞斯执导,莱昂纳多·迪卡普里...浏览全文>>
-
【靳字怎么读】在日常生活中,我们经常会遇到一些不常见的汉字,这些字不仅发音复杂,含义也常常让人感到困惑...浏览全文>>
