相干拉曼显微镜可以通过仪器和计算机的融合进行扩展
拉曼散射是一种非弹性散射过程,它在光子和分子之间交换能量以携带分子振动信息。拉曼显微光谱已成为生物学和医学外科中不可或缺的分析工具,主要是因为它有两个“自由”:无标记和无水背景。
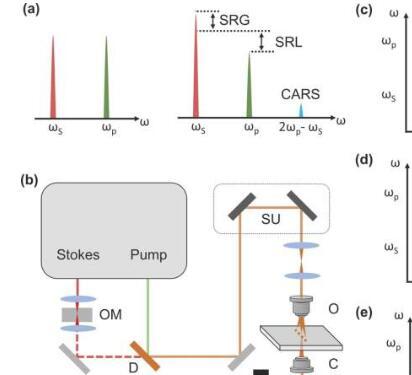
这些好处使我们能够在没有内源性扰动的情况下研究活体样品。此外,拉曼峰的光谱带宽比荧光染料的发射光谱窄得多,这使得在同一环境中同时研究各种代谢物质成为可能。
在eLight上发表的一篇新论文中,波士顿大学的林浩南博士和程继新教授回顾了相干拉曼散射(CRS)的仪器和计算方法的结合。
尽管具有显著优势,但拉曼散射的一个根本缺点在于其横截面严重受限。典型的拉曼横截面为 10-30厘米2每个分子,导致每个焦点的信号积分时间非常长,从几秒钟到几分钟。这种有限的速度使得对动态系统进行逐像素成像变得不切实际。引入了非线性光学过程来相干地增强拉曼信号并打破基本的横截面限制。
使用两个同步的超快激光器,相干拉曼信号在相干反斯托克斯拉曼散射(CARS)和受激拉曼散射(SRS)中产生。在CRS中,两个激光场与目标分子同步相互作用。当跳动频率与拉曼振动模式匹配时,就会发生相干放大的能量传递过程。它湮灭泵浦光子,将其转换为斯托克斯光束并以新的频率产生光子。
稀而实实现了基于生物样品固有拉曼峰的高速化学成像。然而,生物样品是复杂的微系统,由各种代谢物组成,这些代谢物通常具有光谱重叠,特别是在强而拥挤的碳氢(CH)区域。
它阻碍了使用窄带单色CRS对细胞和组织中化学物质的定量和鉴定。在过去的几年中,人们已经做出了重大努力来开发高光谱CRS,在每个像素上产生拉曼光谱。
高光谱图像为破译复杂环境中的化学成分和丰度信息提供了潜力。然而,由于原始图像的高维性,这些信息并不容易获得。需要算法来识别主要的纯成分并分解浓度图。
在高光谱CRS仪器发展的同时,已经报道了各种高光谱图像解混方法。根据是否提供了有关纯组分组成的先验信息,我们将它们分为有监督或无监督的方法。
仪器创新将稀而实成像的速度推向了高达 2 kHz 帧速率、高达 3500 cm 的光谱覆盖范围-1,每个光谱的频谱采集速度高达 5 μs。然而,由于由CRS的灵敏度极限决定的物理极限,这些条件无法同时实现。
例如,进一步提高速度会降低设置的信噪比(SNR),使其不适用于生物医学应用。在光损伤的约束下,这种权衡可以作为设计空间来传达。它是一个与代表速度、频谱带宽和信噪比的三个轴相交的超平面。仪器的优化使系统能够在超平面上达到最佳条件点,但超越它仍然具有挑战性。
研究小组介绍了用于推动CRS化学显微镜边界的各种计算方法。必须注意计算算法的适用范围,以避免对测量的错误解释。评估前向模型是否可以适当地描述潜在的物理过程至关重要。它涉及测量噪声的统计分布、成像系统的图像卷积核和其他技术。
应进行严格的实验来表征正向模型并校准模型参数。当使用先前的模型/正则化时,需要全面了解信号。先前模型的超参数优化对于产生正确的结果至关重要,并且可能需要迭代更新和验证。
对于深度学习应用,虽然减轻了对逆问题进行复杂建模的任务,但需要适当选择网络结构和足够大的训练和验证数据集。
展望未来,研究团队预计仪器的进步将继续提高时间、空间和光谱维度的数据吞吐量。它们应该提供更多关于数据结构的功能,例如稀疏性和相关性。同时,可以利用新的计算方法来打破设计空间的权衡,为生物医学研究提供丰富的化学成分。随着计算光学显微镜的快速发展,我们预计会有更多的想法渗透到稀而实中。
由于大多数计算方法都专注于宽场实现,因此转换为CRS显微镜并非易事。需要进行广泛的建模、系统设计和算法开发,以确保适用于CRS成像。未来,计算方法将发挥更加关键的作用,因为现有方法仍然可以促进新建立的设计空间。可能会出现新的方法,以实现视场、成像深度和空间分辨率等方面的突破。
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!
-
【经典句子大全】在日常生活中,无论是写作、演讲还是表达情感,一句经典的句子往往能起到画龙点睛的作用。它...浏览全文>>
-
【经典句句戳心的话】在生活的长河中,有些话虽然简单,却能直击人心,让人久久不能忘怀。这些句子往往蕴含着...浏览全文>>
-
【经典精辟句子】在日常生活中,我们常常会遇到一些让人深思、令人难忘的句子。这些句子简洁有力,富有哲理,...浏览全文>>
-
【经典惊悚片有哪些】惊悚片以其紧张的节奏、扣人心弦的情节和令人不安的氛围,成为电影史上最受欢迎的类型之...浏览全文>>
-
【经典教师简单自我介绍】在教育工作中,教师的自我介绍是展示个人风格、教学理念和职业态度的重要方式。一个...浏览全文>>
-
【经典简短句子一句话】在日常生活中,一句经典而简短的句子往往能给人留下深刻印象。它们简洁有力,蕴含深意...浏览全文>>
-
【禁不住念什么】在日常生活中,我们常常会遇到一些词语让人“禁不住”去读、去想,甚至去写。其中,“禁不住...浏览全文>>
-
【禁闭岛结局】《禁闭岛》(英文名:Shutter Island)是一部由马丁·斯科塞斯执导,莱昂纳多·迪卡普里奥主演...浏览全文>>
-
【禁闭岛的结局真相】《禁闭岛》(英文名:Shutter Island)是一部由马丁·斯科塞斯执导,莱昂纳多·迪卡普里...浏览全文>>
-
【靳字怎么读】在日常生活中,我们经常会遇到一些不常见的汉字,这些字不仅发音复杂,含义也常常让人感到困惑...浏览全文>>
