当细胞自我消化时:遗传性神经退行性疾病如何发展
口袋、管子和囊状膜结构的缠结贯穿人类、动物、植物和真菌的细胞——内质网,简称ER。在ER中,蛋白质被制造,折叠成它们的三维结构并修饰,产生脂质和激素,并控制细胞中的钙浓度。此外,ER构成了细胞运输系统的基础,将错误折叠的蛋白质喂入细胞内处置,并使进入细胞的毒素无害。
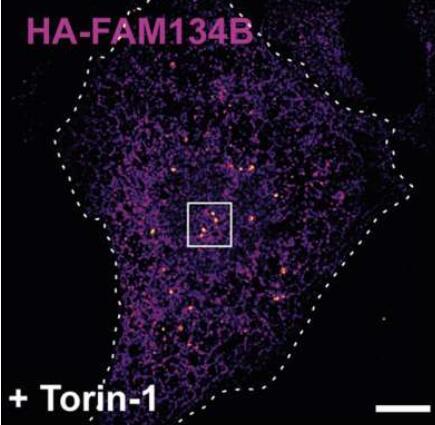
鉴于其多项任务,ER 正在不断进行改造。一种称为ER-phagy的过程(大致是“ER的自我消化”)负责ER降解。涉及的是一组信号接收蛋白 - 受体 - 负责ER的膜曲率,从而负责其在细胞中的多种形式。在ER-phagy中,受体积聚在ER上的特定位点并增加膜曲率,以至于ER的一部分被细胞循环结构(自噬体)扼杀并分解成其组成部分。
在细胞培养实验、生化和分子生物学研究以及计算机模拟中,由法兰克福歌德大学Ivan Đikić教授领导的科学团队首先测试了膜曲率受体FAM134B,并证明泛素促进和稳定ER膜中FAM134B蛋白簇的形成。因此,泛素驱动ER-phagy。
Đikić解释说:“泛素导致FAM134B簇变得更加稳定,ER在这些位点隆起更多。更强的膜曲率导致簇的进一步稳定,此外,吸引额外的膜曲率蛋白。所以泛素的作用是自我强化的。研究人员还能够使用超高分辨率显微镜检测簇的形成。
“为了实现这一功能,泛素改变了部分FAM134B蛋白的形状。这是泛素的另一个方面,它执行一系列几乎令人难以置信的任务,以保持所有不同的细胞功能工作,“Đikić继续说道。
ER-phagy的重要性由缺陷的FAM134B蛋白引起的疾病证明。由耶拿大学医院的Christian Hübner教授领导的研究小组先前发现了FAM134B基因的突变,导致非常罕见的遗传性感觉和自主神经病变(HSAN),其中感觉神经死亡。结果,患者无法正确感知疼痛和温度,这可能导致不正确的压力或伤害被忽视并发展成慢性伤口。在耶拿大学医院和法兰克福歌德大学的长期合作中,FAM134B被确定为ER-phagy的第一个受体。他们的研究结果在发表在《自然》杂志上的两篇论文中有详细说明。
另一种称为ARL6IP1的膜曲率蛋白的突变会导致类似的神经退行性疾病,该疾病将感觉缺陷与腿部肌肉硬化(痉挛)相结合。由Christian Hübner和Ivan Đikić领导的科学团队现在已经确定ARL6IP1也属于ER-phagy机制,并且在ER-phagy期间也普遍存在。
Christian Hübner解释说:“在没有ARL6IP1蛋白的小鼠中,我们可以看到ER随着细胞年龄的增长而几乎膨胀和退化。这导致错误折叠的蛋白质或蛋白质团块的积累,这些蛋白质或蛋白质团块不再在细胞中处理。结果,特别是神经细胞,其更新速度不如其他身体细胞快,死亡,导致受影响患者和转基因小鼠的临床症状。我们从数据中假设,两个膜曲率受体FAM134B和ARL6IP1在ER-phagy期间形成混合簇,并相互依赖以控制ER的正常大小和功能。
然而,总的来说,研究团队已经朝着理解ER-phagy迈出了决定性的一步,Đikić确信。“我们现在更好地了解细胞如何控制其功能,从而产生我们称之为细胞稳态的东西。在生物学中,这些知识可以深入了解我们细胞的惊人成就,对于医学来说,这对于理解疾病,及时诊断疾病以及通过开发新疗法来帮助患者至关重要。
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!
-
【精心地造造句】在日常写作和语言表达中,“精心地”是一个常见的副词,用来强调动作的细致、认真和用心。它...浏览全文>>
-
【精心的注音】在日常学习和工作中,注音是一项非常基础但重要的技能。无论是语文学习、普通话考试,还是语言...浏览全文>>
-
【精心的造句子二年级造】在小学语文教学中,造句是培养孩子语言表达能力的重要环节。尤其是对于二年级的学生...浏览全文>>
-
【精心的近义词】在日常生活中,我们经常需要表达“认真、细致、用心”这样的意思。而“精心”正是一个常用于...浏览全文>>
-
【精心部署的意思是什么】2、直接用原标题“精心部署的意思是什么”生成一篇原创的优质内容,要求:以加表格的...浏览全文>>
-
【精细化管理的原则不包括什么】在企业管理中,精细化管理是一种以提高效率、降低成本、提升质量为目标的管理...浏览全文>>
-
【精细化工专业是干嘛的】精细化工专业是一门涉及化学、材料科学和工程技术的交叉学科,主要研究如何通过化学...浏览全文>>
-
【精卫填海是什么意思】“精卫填海”是一个源自中国古代神话故事的成语,最早见于《山海经·北山经》。这个故...浏览全文>>
-
【经典句子大全】在日常生活中,无论是写作、演讲还是表达情感,一句经典的句子往往能起到画龙点睛的作用。它...浏览全文>>
-
【经典句句戳心的话】在生活的长河中,有些话虽然简单,却能直击人心,让人久久不能忘怀。这些句子往往蕴含着...浏览全文>>
