综合结构生物学为囊性纤维化治疗提供新线索
圣裘德儿童研究医院和洛克菲勒大学的科学家结合他们的专业知识,更好地了解囊性纤维化跨膜传导调节剂(CFTR)。CFTR的突变导致囊性纤维化,这是一种无法治愈的致命疾病。
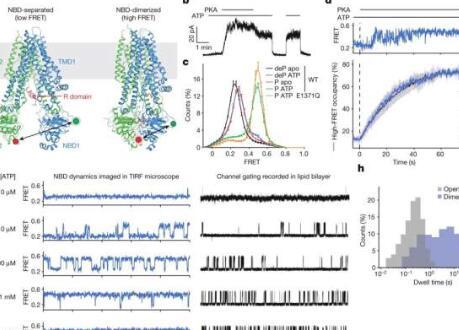
目前使用称为增强剂的药物的疗法可以增强某些患者的CFTR功能;但是增强剂的工作原理尚不清楚。新发现揭示了CFTR如何机械地发挥作用,以及疾病突变和增强剂如何影响这些功能。有了这些信息,研究人员可能能够设计更有效的囊性纤维化治疗方法。这项研究今天发表在《自然》杂志上。
囊性纤维化是一种遗传性疾病,会导致人们产生太稠和粘稠的粘液。这会阻塞气道并导致肺损伤,并导致消化问题。这种疾病影响了美国约35,000人。CFTR是一个阴离子通道,是维持盐和液体在上皮和其他膜上正确平衡的通道。CFTR突变是导致囊性纤维化的原因,但这些突变可以不同地影响CFTR功能。因此,一些用于治疗该疾病的药物只能部分恢复CFTR特定突变形式的功能。
CFTR的结构,以前在洛克菲勒大学的Jue Chen博士及其同事的实验室中捕获,揭示了两种不同的构象(形状)。这些静态图像使研究人员能够看到通道何时打开或关闭,但状态之间的转换尚未完全理解。
因此,构象变化被推断为打开和关闭通道很重要,解释了CFTR的电生理特性,这些特性已经分析了几十年。这些发现激发了人们对直接实时可视化CFTR结构转变的兴趣,并研究了疾病突变和用于增强患者CFTR功能的药物如何影响构象变化。
“通过这次合作,我们有机会真正了解结构和功能之间的关系,”共同通讯作者Scott Blanchard博士说,圣裘德结构生物学系。“我们实验室先前对核糖体和G蛋白偶联受体的工作表明这是可能的,但很少有单一蛋白质比CFTR与疾病治疗更相关,因为囊性纤维化的治疗旨在改善这种蛋白质突变形式的缺陷。
“进行生物物理测量并获得这些类型的定量见解的能力是单分子成像的进步之一,它从未停止让我感到惊讶。
合作带来突破
研究小组的互补专业知识是他们发现的关键。通过电生理学和结构研究,洛克菲勒团队能够指导圣裘德团队放置单分子探针。通过部署单分子荧光共振能量转移(smFRET),St. Jude团队能够为CFTR机器的移动部件提供新的见解。
通过冷冻电子显微镜,电生理学和smFRET的整合,研究小组能够建立更好地了解CFTR工作原理所需的联系。
“通过了解CFTR的结构和行为,这里有潜力帮助囊性纤维化患者,”洛克菲勒大学的第一作者Jesper Levring说。“使用这些方法 - 单通道电生理学和smFRET,一次观察这些分子 - 我们可以将通道的功能与构象变化相关联,并将其与潜在的结构生物学联系起来。
研究人员发现,CFTR表现出分层门控机制。CFTR的两个核苷酸结合结构域在通道打开之前二聚化(合并)。与ATP水解(释放能量的反应)相关的二聚通道内的构象变化调节氯离子电导。
这一机制见解的重要性进一步揭示了这一机制见解的重要性,发现增强剂药物Ivacaftor和GLPG1837通过在核苷酸结合结构域二聚化时增加孔隙开口来增强通道活性。导致囊性纤维化的突变会降低二聚化的效率。这些见解将有助于为寻找更有效的临床疗法提供信息。
“这项工作最令人满意的是,我们已经回答了一个关于CFTR如何工作的问题,这个问题多年来一直是该领域争论的主题,”该研究的共同通讯作者陈说。
“每种方法都有局限性,所以你可以有很好的数据,但仍然没有答案。通过结合方法,我们已经得到了一个统一的机制,使我们能够深入了解这种分子是如何工作的。有了这种理解,我们就可以测试突变或药物如何影响功能,这最终是我们获得更好治疗方法的方式。
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!
-
【禁不住念什么】在日常生活中,我们常常会遇到一些词语让人“禁不住”去读、去想,甚至去写。其中,“禁不住...浏览全文>>
-
【禁闭岛结局】《禁闭岛》(英文名:Shutter Island)是一部由马丁·斯科塞斯执导,莱昂纳多·迪卡普里奥主演...浏览全文>>
-
【禁闭岛的结局真相】《禁闭岛》(英文名:Shutter Island)是一部由马丁·斯科塞斯执导,莱昂纳多·迪卡普里...浏览全文>>
-
【靳字怎么读】在日常生活中,我们经常会遇到一些不常见的汉字,这些字不仅发音复杂,含义也常常让人感到困惑...浏览全文>>
-
【靳这个字怎么念】“靳”是一个较为少见的汉字,常用于人名或姓氏中。对于不熟悉该字的人来说,可能会不知道...浏览全文>>
-
【靳怎么读音】“靳”是一个较为少见的汉字,常出现在人名或地名中。对于不熟悉这个字的人来说,可能会对其读...浏览全文>>
-
【靳东个人资料】靳东是中国内地著名的男演员,因在多部影视作品中表现出色而广受观众喜爱。他以沉稳的气质、...浏览全文>>
-
【靳东的妹妹为什么叫高露】很多人对“靳东的妹妹为什么叫高露”这一问题感到疑惑,因为从名字上看,似乎“高...浏览全文>>
-
【金枝玉叶剧情简介】《金枝玉叶》是一部以民国时期为背景的都市情感剧,讲述了出身名门的女主角在家族、爱情...浏览全文>>
-
【金枝玉叶花语是什么】“金枝玉叶”是一种常见的观赏植物,因其叶片厚实、色泽翠绿、形态美观而广受喜爱。在...浏览全文>>
