研究人员进一步揭示了细胞中的锌稳态
一个研究小组发现了锌转运蛋白复合物如何调节锌离子(Zn2+)在高尔基体不同区域的浓度,并揭示了这种机制微调伴侣蛋白ERp44。
这些发现于9年2023月<>日发表在《自然通讯》杂志上,揭示了锌稳态背后的关键化学和细胞生物学机制,这是避免糖尿病、癌症、生长障碍和免疫缺陷等致命疾病所必需的。
作为一种微量元素,锌对我们的健康至关重要。锌2+对酶催化、蛋白质折叠、DNA结合和调节基因表达至关重要,近10%的人蛋白质组结合Zn2+因为它们的结构成熟和功能。
分泌蛋白如激素、免疫球蛋白和凝血因子在内质网 (ER) 中合成和折叠,内质网 (ER) 是一个复杂的小管膜网络。随后,它们被运输到高尔基体并在高尔基体中成熟,高尔基体是由多个扁平的囊组成的细胞器,称为池,在将蛋白质引导到特定目的地之前对其进行分类和处理。伴侣蛋白对于维持蛋白质稳态和防止在这些细胞器中形成错误折叠或聚集的蛋白质至关重要。
该小组先前的研究表明,锌2+在高尔基体中,在包括ER和高尔基体的早期分泌途径中的蛋白质质量控制中起着至关重要的作用。该系统由ER-高尔基体循环伴侣蛋白ERp44介导。
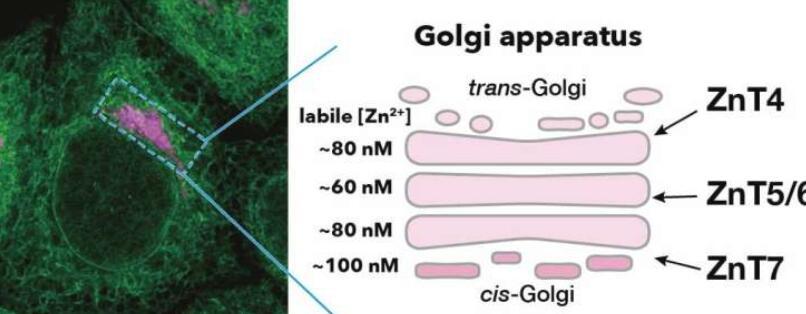
在高尔基体中,存在三种ZnT配合物:ZnT4,Znt5 / 6和ZnT7。然而,直到现在,锌的机制如何2+稳态在高尔基体中维持仍不清楚。
“使用化学生物学和细胞生物学方法,我们发现这些ZnT复合物调节Zn2+集中在不同的高尔基体隔室,即顺式,内侧和跨高尔基体池,“该研究的通讯作者,东北大学先进材料科学多学科研究所教授Kenji Inaba说。“我们还进一步阐明了由ZnT复合物控制的ERp44的细胞内运输,定位和功能。
ERp44在高尔基体上捕获未成熟的分泌蛋白,以防止其异常分泌。先前的研究表明,抑制ERp44表达的小鼠患有心力衰竭和低血压。
此外,许多分泌锌酶与各种疾病有关,包括癌细胞转移和低磷酸血症。这些酶依赖于高尔基体驻留的ZnT复合物来获取Zn2+用于酶活性。ZnT5被抑制的雄性小鼠经历了由心律失常引起的死亡,因此Zn可能存在相关性2+心血管疾病的稳态。
“我们的研究结果将有助于我们了解Zn破坏的机制。2+早期分泌途径中的稳态导致病理状况的发展,“稻叶补充道。
该小组希望他们研究中采用的策略可以描绘出维持细胞内Zn的机制的更大图景。2+稳态,推荐未来可以测量锌的研究2+在其他细胞器中,例如线粒体和细胞核。
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!
-
【禁不住念什么】在日常生活中,我们常常会遇到一些词语让人“禁不住”去读、去想,甚至去写。其中,“禁不住...浏览全文>>
-
【禁闭岛结局】《禁闭岛》(英文名:Shutter Island)是一部由马丁·斯科塞斯执导,莱昂纳多·迪卡普里奥主演...浏览全文>>
-
【禁闭岛的结局真相】《禁闭岛》(英文名:Shutter Island)是一部由马丁·斯科塞斯执导,莱昂纳多·迪卡普里...浏览全文>>
-
【靳字怎么读】在日常生活中,我们经常会遇到一些不常见的汉字,这些字不仅发音复杂,含义也常常让人感到困惑...浏览全文>>
-
【靳这个字怎么念】“靳”是一个较为少见的汉字,常用于人名或姓氏中。对于不熟悉该字的人来说,可能会不知道...浏览全文>>
-
【靳怎么读音】“靳”是一个较为少见的汉字,常出现在人名或地名中。对于不熟悉这个字的人来说,可能会对其读...浏览全文>>
-
【靳东个人资料】靳东是中国内地著名的男演员,因在多部影视作品中表现出色而广受观众喜爱。他以沉稳的气质、...浏览全文>>
-
【靳东的妹妹为什么叫高露】很多人对“靳东的妹妹为什么叫高露”这一问题感到疑惑,因为从名字上看,似乎“高...浏览全文>>
-
【金枝玉叶剧情简介】《金枝玉叶》是一部以民国时期为背景的都市情感剧,讲述了出身名门的女主角在家族、爱情...浏览全文>>
-
【金枝玉叶花语是什么】“金枝玉叶”是一种常见的观赏植物,因其叶片厚实、色泽翠绿、形态美观而广受喜爱。在...浏览全文>>
